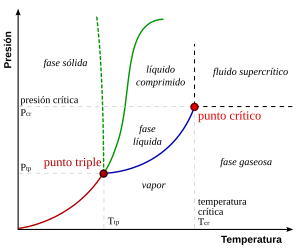
Se denomina ciclo termodinámico a cualquier serie de procesos termodinámicos en los que un sistema parte de una situación inicial y tras aplicar dichos procesos regrese al estado inicial. Como procesos termodinámicos se conoce a la variación de las propiedades termodinámicas del sistema (presión, entropía, volumen, entalpía y temperatura) desde un estado inicial a un estado final.
Al realizar un ciclo completo, la variación de la energía interna debe ser nula por lo tanto el calor transferido por el sistema debe de ser igual al trabajo realizado por el sistema (como dicta la primera ley de la termodinámica). Lo importante es que gracias a esta propiedad se puede obtener trabajo de un sistema mediante un aporte calorífico. Si el rendimiento fuese perfecto todo el calor que se suministra se podría transformar en calor, pero esto no es así ya que hay pérdidas de calor.
Los ciclos termodinámicos más comunes son:
- Ciclo Otto
- Ciclo Diesel
- Ciclo Brayton
- Ciclo Carnot
- Ciclo Rankine
El ciclo Otto es el ciclo termodinámico que se aplica en los motores de combustión interna de encendido provocado (motores de gasolina). Inventado por Nicolaus Otto en 1876. Se caracteriza porque en una primera aproximación teórica, todo el calor se aporta a volumen constante.
El ciclo del motor diésel lento (en contraposición al ciclo rápido, más aproximado a la realidad) ideal de cuatro tiempos es una idealización del diagrama del indicador de un motor Diesel, en el que se omiten las fases de renovación de la carga, y se asume que el fluido termodinámico que evoluciona es un gas perfecto, en general aire. Además, se acepta que todos los procesos son ideales y reversibles, y que se realizan sobre el mismo fluido. Aunque todo ello lleva a un modelo muy aproximado del comportamiento real del motor, permite al menos extraer una serie de conclusiones cualitativas con respecto a este tipo de motores. No hay que olvidar que los grandes motores marinos y de tracción ferroviaria son del ciclo de 2 tiempos diesel.

El ciclo Brayton, también conocido como ciclo Joule o ciclo Froude, es un ciclo termodinámico consistente, en su forma más sencilla, en una etapa de compresión adiabática, una etapa de calentamiento isobárico y una expansión adiabática de un fluido termodinámico compresible. Es uno de los ciclos termodinámicos de más amplia aplicación, al ser la base del motor de turbina de gas, por lo que el producto del ciclo puede ir desde un trabajo mecánico que se emplee para la producción de electricidad en los quemadores de gas natural o algún otro aprovechamiento –caso de las industrias de generación eléctrica y de algunos motores terrestres o marinos, respectivamente–, hasta la generación de un empuje en unaerorreactor.

El ciclo de Carnot se produce en un equipo o máquina cuando trabaja absorbiendo una cantidad de calor Q1 de una fuente de mayor temperatura y cediendo un calor Q2 a la de menor temperatura produciendo un trabajo sobre el exterior.
El rendimiento de este ciclo viene definido por: 

y, como se verá adelante, es mayor que el producido por cualquier máquina que funcione cíclicamente entre las mismas fuentes de temperatura. Una máquina térmica que realiza este ciclo se denomina máquina de Carnot.
Como todos los procesos que tienen lugar en el ciclo ideal son reversibles, por lo que el ciclo puede invertirse y la máquina absorbería calor de la fuente fría y cedería calor a la fuente caliente, teniendo que suministrar trabajo a la máquina. Si el objetivo de esta máquina es extraer calor de la fuente caliente se denomina máquina frigorífica, y si es ceder calor a la fuente fría, bomba de calor.
El ciclo de Rankine es un ciclo termodinámico que tiene como objetivo la conversión de calor en trabajo, constituyendo lo que se denomina un ciclo de potencia. Como cualquier otro ciclo de potencia, su eficiencia está acotada por la eficiencia termodinámica de un ciclo de Carnot que operase entre los mismos focos térmicos (límite máximo que impone el Segundo Principio de la Termodinámica). Debe su nombre a su desarrollador, el ingeniero y físico escocés William John Macquorn Rankine.

Bibliografía:
http://energiadoblecero.com/definiciones/ciclos-termodinamicos
https://es.wikipedia.org/wiki/Ciclo_de_Rankine
https://es.wikipedia.org/wiki/Ciclo_de_Carnot
https://es.wikipedia.org/wiki/Ciclo_Brayton
https://es.wikipedia.org/wiki/Ciclo_Otto
https://es.wikipedia.org/wiki/Ciclo_Diesel
https://www.youtube.com/watch?v=um2U0GQuhAo
https://www.youtube.com/watch?v=yHyeHdR1m5w
https://www.youtube.com/watch?v=u7geC32XZrY
https://www.youtube.com/watch?v=ancwKelxUNs
https://www.youtube.com/watch?v=dTOuoIXqQwc